
Às vezes, detalhes aparentemente insignificantes têm um impacto incrível no quadro geral. Este princípio é aplicável a muitas áreas da nossa vida: o sorriso misterioso de Mona Lisa, que deu origem a muitas teorias e especulações; uma linha de código que pode alterar completamente a funcionalidade do programa; a ordem de arranjo dos átomos, que altera as propriedades de uma substância. Hoje falaremos sobre o último. Cientistas da Universidade de Tsukuba (Japão) apresentaram uma teoria segundo a qual é possível criar uma nova estrutura de diamante, que será mais difícil que o mineral conhecido. Os cientistas chamaram sua criação de "diamante penta". O que é necessário para criar um diamante penta, que propriedades ele possui e onde pode ser usada uma substância tão incomum? Encontraremos respostas para essas perguntas no relatório dos cientistas. Ir.
Base de estudo
O carbono é um elemento onipresente na tabela periódica e é a base para uma grande variedade de compostos orgânicos e inorgânicos. Na natureza, o carbono pode ser encontrado em quase toda parte: óleo e turfa, metano e dióxido de carbono, músculos e ossos, etc. etc. Em suma, o carbono é considerado um dos principais componentes da vida na Terra por um motivo.
Certas substâncias ou elementos químicos podem existir em diferentes formas sob diferentes condições. Isso é chamado alotropia. O carbono é o detentor do recorde neste negócio, pois possui mais de 9 modificações alotrópicas.
As razões para a presença de um número tão grande de alótropos de carbono são hibridação orbital, condições de contorno e defeitos topológicos. Três formas de hibridação orbital (sp, sp 2 e sp 3) representam alótropos que cobrem todas as dimensões:
- cadeias unidimensionais para sp (polyine);
- folha bidimensional para sp 2 (grafeno);
- Malha 3D para sp 3 (diamante).
Além disso, as condições de contorno e os defeitos topológicos permitem que o carbono forme alótropos adicionais com morfologias exclusivas: por exemplo, fulereno e nanotubos de carbono, que possuem propriedades eletrônicas e estruturais incomuns.
Uma variedade de fulerenos.
Alótropos de carbono, constituídos por átomos de sp 2 e sp 3 C, atraem a atenção dos pesquisadores devido à sua diversidade morfológica, devido ao grande número de combinações de átomos de sp 2 e sp 3 em um sistema. Um exemplo disso são os fulerenos tratados com alta pressão e temperatura (por exemplo, C 60), que pode ter uma baixa densidade de massa devido a ligações covalentes entre fulerenos e poros nanosizados.
Além disso, existem estudos que descrevem a rápida têmpera do carbono amorfo, o que leva à formação de um alótropo híbrido sp 2 -sp 3 -Q-carbon , que possui magnetismo e dureza superiores ao diamante.
O carbono pode ser mais ou menos chamado de plasticina nas mãos dos cientistas, porque pode ser usado para criar muitas substâncias de diferentes propriedades e funcionalidades; haveria desejo e imaginação.
Neste trabalho, os cientistas apresentaram um estudo teórico de um alótropo tridimensional de carbono, constituído por átomos C sp 2 e sp 3(diamante penta). Ele pode ser obtido por copolimerizao de moléculas de hidrocarbonetos contendo anéis pentagonais (espiro [2.4] heptano-4,6-dieno (C 7 H 8 ) e [5.5.5.5] -phenestran-tetraine).
O diamante penta consiste em anéis pentagonais com o grupo espacial Fm¯3m devido à copolimerização dessas moléculas constituintes. Os cálculos mostraram que o diamante penta possui um módulo de alto volume * - 381 GPa, que é aproximadamente 80% do diamante. Isso sugere que o diamante penta é um alótropo de carbono sólido.
Além disso, possui uma razão de Poisson negativa * (-0,241), o que leva ao módulo de Young * extremamente alto (1691 GPa) e ao módulo de cisalhamento * (1113 GPa), superior à do diamante ou de outros carbonos ultra-fortes.
Módulo de elasticidade a granel * - uma característica da capacidade de uma substância resistir à compressão geral.
Relação de Poisson * - a relação entre a compressão lateral relativa e a tensão longitudinal relativa.
Módulo de Young * (módulo de elasticidade) - uma avaliação da capacidade de um material resistir à tensão, compressão sob deformação elástica.
Módulo de cisalhamento * - uma avaliação da capacidade do material de resistir à deformação de cisalhamento.O diamante Penta é um semicondutor com uma folga de banda indireta * de 2,25 eV, que deverá ter uma alta mobilidade do furo * .
* — , .
* — .
Todos os cálculos foram realizados com base na teoria funcional da densidade implementada no pacote de software STATE ( STF-ElectronMo ).
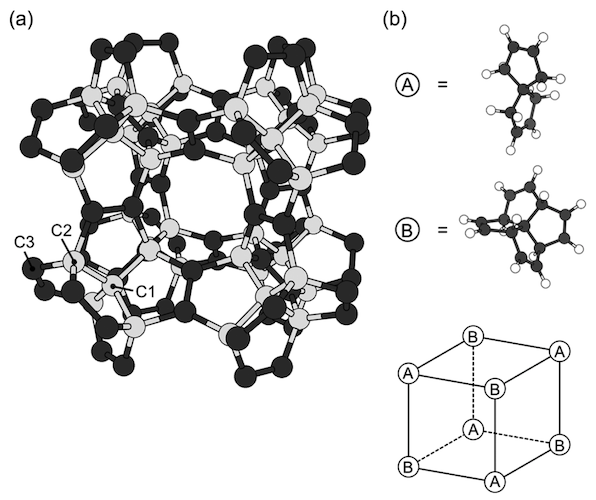
Imagem # 1
Os diagramas acima mostram a geometria otimizada de um pentágono com um parâmetro de rede de 9.195 Å e o grupo espacial Fm¯3m. A rede covalente consiste exclusivamente em pentágonos, nos quais três das cinco arestas são separadas por pentágonos vizinhos ( 1a ), devido à copolimerização de C 7 H 8 e [5.5.5.5] -fenestran-tetrain, que estão alternadamente localizados nos vértices da rede cúbica ( 1b ).
De acordo com essas moléculas constituintes e seu arranjo, a célula unitária de um diamante peta contém 22 átomos de carbono: 10 são sp3 e 12 - por sp 2 átomos . Além disso, os operadores de simetria pertencentes ao grupo Fm¯3m reduzem o número de regiões atômicas independentes para três.
Como a rede é composta de átomos de carbono sp 2 (coordenação tripla) e sp 3 (coordenação quádrupla), as ligações covalentes são classificadas em dois grupos. Os comprimentos de ligação calculados relacionados aos átomos de sp 3 são 1,556 Å para ligações C1-C1 e 1,520 Å para C2-C3. Mas o comprimento da ligação (C3-C3) para sp 2 átomos é 1,349 Â, o que confirma a presença de uma ligação dupla em sp 2 átomos .
Como mostrado em 1a, o diamante penta possui grandes "poros" cúbicos com bordas 3.664 Å, cercados por uma rede covalente pentagonal. Consequentemente, tem uma baixa densidade de massa com uma densidade de 2,26 g / cm 3 , como o grafite, mas 36% menos do que o diamante.
A energia total relativa de um diamante penta é de 275 meV / átomo, o que corresponde a um diamante clássico. Mas a energia total é maior que a do diamante, grafite e outros materiais de carbono duro, embora menor que a do C60, que é conhecido por ser um alótropo de carbono metaestável no espaço zero. A energia total moderada é explicada pela distorção estrutural dos ângulos de ligação dos átomos de sp 2 e sp 3 .
Em relação aos átomos sp 3 : apesar do átomo C1 ter um sp quase perfeito3 hibridização com um ângulo de ligação θ212 = 109,4 °, o átomo de C2 tem ângulos de ligação θ212 = 115,9 ° e θ323 = 101,9 °, que são mais largos e mais estreitos que os ângulos de ligação correspondentes do sp ideal 3 . Em relação sp 2 átomos : devido à rede pentagonal, o ângulo de ligação relacionada com C3 é θ232 = 133,4 ° e θ233 = 113,3 °, que é também maior e menor do que os correspondentes ângulos de ligação para ideal sp 2 .
Energia moderada também aumenta a energia de formação (? E) de penta diamante mediante copolimerização directa de C 7 H 8 e [5.5.5.5] -phenestran-tetraine:
espironadieno + fenestratetraeno = diamante penta + 12H 2 + ΔEA energia calculada de formação é 0,31 eV / átomo, reflectindo o consumo de energia para a formação de uma rede covalente de sp 2 e sp 3 átomos de carbono, com ângulos de ligação distorcidas.
Assim, espera-se que o diamante penta seja sintetizado usando a reação de Ullmann para o bromospiro [4.4] nona-2.7-dieno e o bromo [5.5.5.5] -fenestratetraeno em vez de sua forma primária.
Em seguida, foi realizado um estudo da estabilidade térmica do diamante penta, modelando a dinâmica molecular a uma temperatura de 4000 K. Para entender quais alterações estruturais podem ocorrer, os cálculos da dinâmica molecular foram realizados com uma temperatura constante para uma célula atômica expandida (88 átomos de carbono) por 12 ps (picossegundos, 1 ps = 10-12 s) e para um simplificado (1x1x1) por 146 ps.
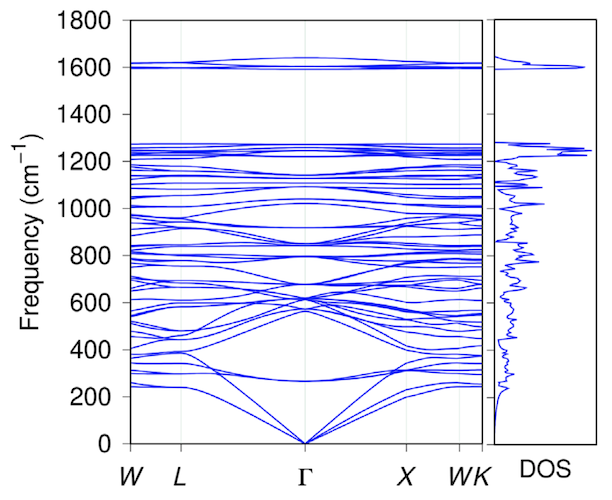
Imagem # 2
De acordo com os resultados da simulação após 14 ps a 4000 K, o diamante penta mantém completamente sua topologia original nas células atômicas complexa e simplificada (gráfico acima).
Consequentemente, o diamante penta é termicamente e energeticamente estável se sintetizado usando os esquemas apropriados propostos neste trabalho.
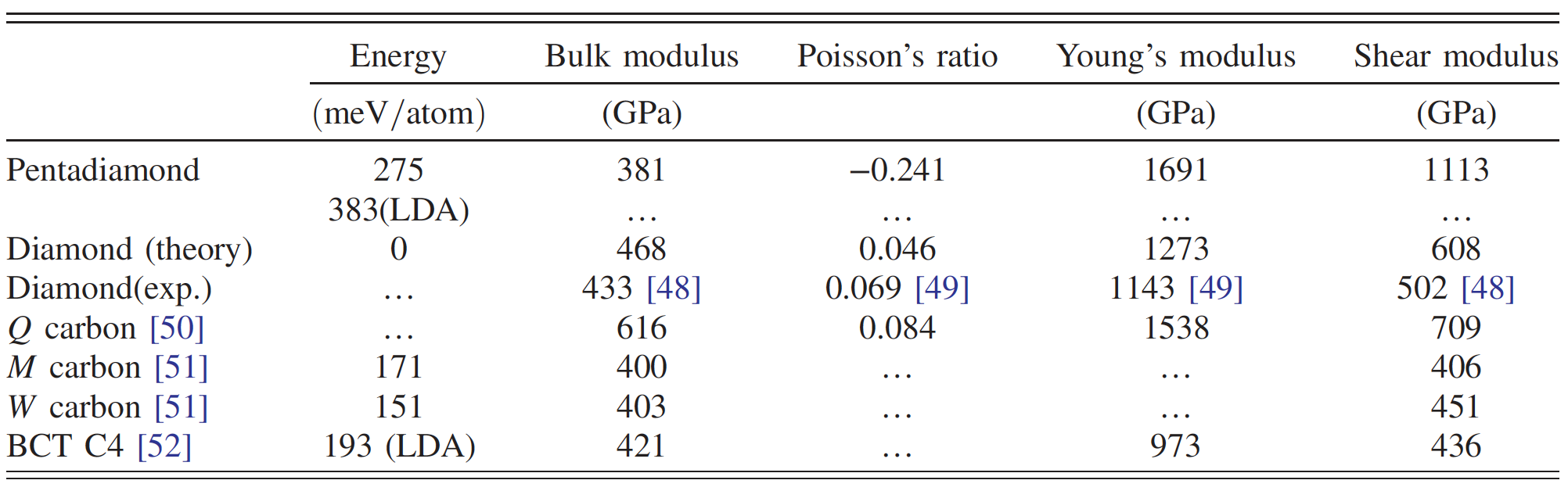
Comparação das propriedades do diamante penta e outros alótropos de carbono.
As propriedades mecânicas do diamante penta foram estudadas por meio de constantes elásticas cij, que são determinadas pela avaliação da diferença finita na energia total em relação às deformações. Os valores calculados das constantes elásticas foram: 1715,3 GPa para s 11 (= s 22 = s 33 ); −283,5 GPa para s12 (= s 13 = s 23 ) e 1187,5 GPa para s 44 (= s 55 = s 66 ).
Note-se também que esses indicadores satisfazem totalmente o critério de estabilidade de Born (com 11 - com 12 > 0, com 11 + 2c 12 > 0 e com 44 > 0), o que indica adicionalmente a estabilidade do diamante penta.
No caso da simetria cúbica, o módulo de elasticidade a granel é calculado pela fórmula: B = (s 11 + 2s 12) / 3. Como resultado, B era igual a 381 GPa, que é mais de 80% do valor correspondente para o diamante. Isso sugere que o diamante penta é um candidato potencial aos alótropos de carbono sólido, embora sua densidade seja bastante baixa (como a da grafite).
Para uma investigação mais aprofundada das propriedades mecânicas, o módulo de Young de penta-diamante foi calculado usando a fórmula:
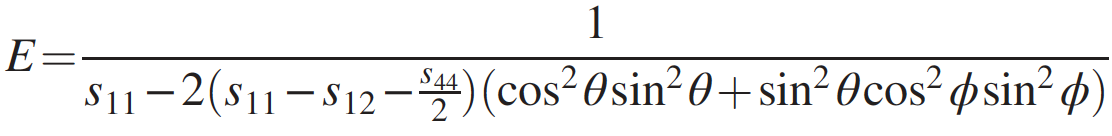
onde θ e ϕ são os ângulos de Euler * , s ij é a complacência elástica determinada por cij com as relações entre s 11 = [c 11 + c 12 ] / [(c 11 - c 12 ) (c 11 + 2c 12 )], s 12 = [-c 12 ] / [(c 11- C 12 ) (C 11 + 2c 12 )] e s 44 = 1 / c 44 .
Ângulos de Euler * - ângulos que descrevem a rotação de um corpo absolutamente rígido no espaço tridimensional.
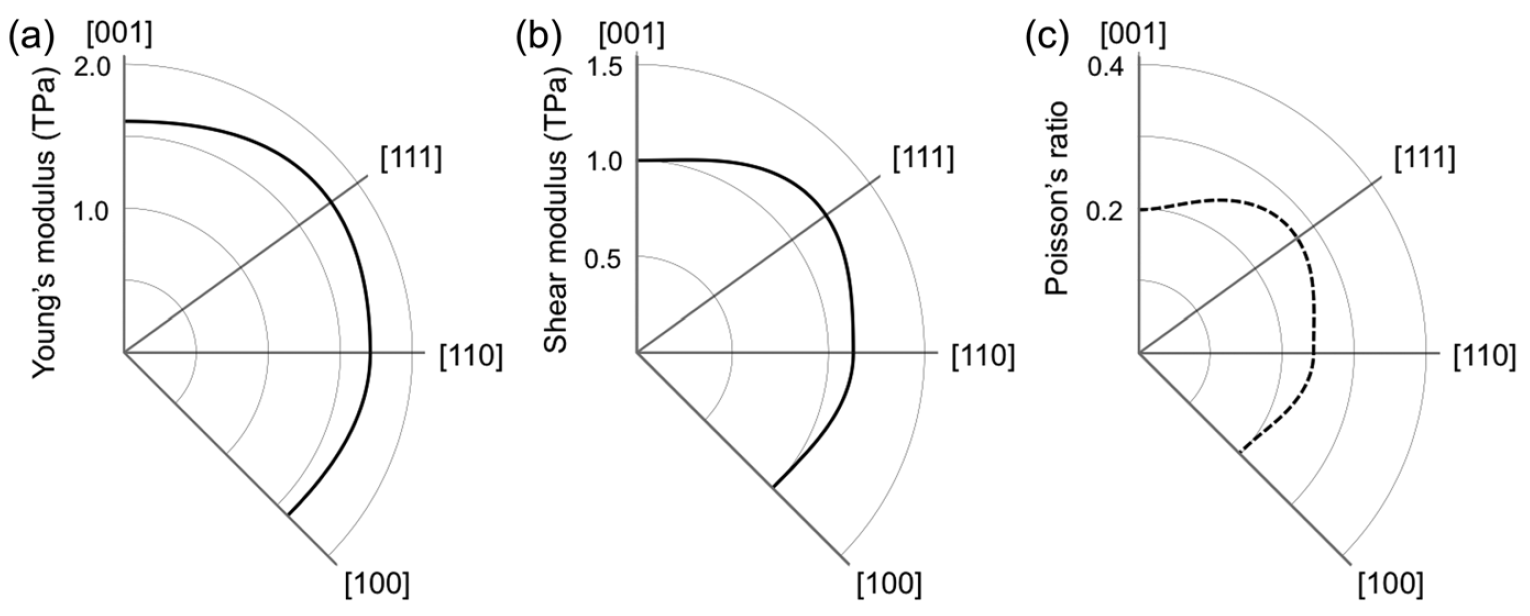
Imagem Nº 3
O módulo de diamante penta de Young é extremamente alto e excede 1,5 TPa em todas as direções ( 3a ). Conhecendo o módulo de Young e o módulo de elasticidade a granel, é possível calcular o módulo de cisalhamento ( 3b ), que também se mostrou bastante alto (1 TPa) para todas as direções.
Consequentemente, o diamante penta pode exibir extrema rigidez em relação a deformações estruturais anisotrópicas. O fato de o módulo de Young e o módulo de cisalhamento serem maiores que os de outros alótropos de carbono duros e super-duros também requer atenção especial (tabela acima).
Tais valores altos dos módulos descritos acima indicam que o diamante penta deve ter uma razão de Poisson negativa. Esta afirmação foi confirmada por cálculos que mostram a razão de Poisson na faixa de -0,20 a -0,28, dependendo das direções da grade ( 3c ). Tais indicadores exclusivos levam ao fato de que a velocidade do som no diamante penta também será bastante alta (28700 m / s versus 12000-18350 m / s para o diamante comum).
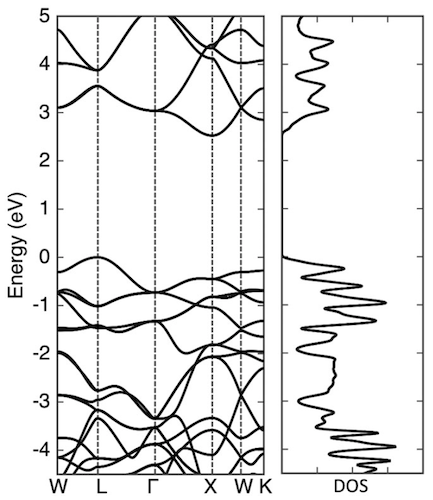
Imagem No. 4
O gráfico acima mostra a estrutura eletrônica e a densidade dos estados do diamante penta, que é um semicondutor com um intervalo de banda indireto de 2,52 eV. As bandas de valência e condução estão localizadas nos pontos L e X, respectivamente. O ramo mais alto da banda de valência e o ramo mais baixo da banda de condução têm dispersão significativa (1 eV ou mais).
Portanto, espera-se que o diamante penta tenha pequenas massas efetivas nas bordas das bandas: as massas calculadas de elétrons no ponto X são 0,98 e 0,67 (menor que a do diamante) ao longo das direções para os pontos Γ e W, respectivamente. Mas a situação em relação à aresta da banda de valência é o oposto: as massas calculadas dos orifícios no ponto L são 1,59 e 0,76 (maior que a do diamante) ao longo das direções para os pontos W e Γ, respectivamente.
A massa moderada de transportadora e a alta densidade de estados nas bordas da banda sugerem que o diamante penta pode ter uma mobilidade moderada de transportadora para um elétron e um buraco. A relação de dispersão e a densidade do estado mostram que o diamante penta possui uma estrutura eletrônica volumétrica tridimensional, como a de um diamante, refletindo sua rede covalente tridimensional com alta simetria.
Imagem №5
Para uma melhor compreensão da estrutura eletrônica do diamante penta, os cientistas realizaram um estudo da função de onda do ramo mais alto e do ramo mais baixo do diamante penta em certos pontos de simetria.
As funções de onda do ramo superior da banda de valência nos pontos L e Γ estão distribuídas pelos átomos de C3, que têm o caráter de uma ligação π, devido ao seu sp 2hibridização. A função de onda do ramo inferior da banda de condução nos pontos Γ e X também é distribuída pelos átomos de C3 com uma natureza π anti-ligante. Os cientistas observam que o estado de valência e o estado de condução não são estados π puros, mas estados hibridizados que contêm uma pequena quantidade do componente σ. Isto significa que os estados electrónicos próximos e em torno das bordas da banda são considerados como estados pi-electrónica de SP 2 C dímeros , que são cerca de 2,6 Å distante das suas oito regiões adjacentes.
Para um conhecimento mais detalhado das nuances do estudo, recomendo que você analise o relatório dos cientistas .
Epílogo
Neste estudo, os cientistas avançaram a teoria de que é possível criar uma estrutura de carbono com melhores propriedades do que o diamante. Os cálculos realizados durante o estudo confirmaram essa conjectura.
Por copolimerização de espiro [2.4] heptano-4,6-dieno (C 7 H 8 ) e [5.5.5.5] -phenestrane-tetrain com Fm¯3m simetria, uma rede covalente pentagonal tridimensional de sp 2 e sp 3 átomos de carbono podem ser sintetizados . Os cientistas chamaram sua criação de diamante penta.
A maioria das propriedades mecânicas do diamante penta é superior às do diamante convencional conhecido por nós ou por outros alótropos de carbono duro. Curiosamente, o diamante penta é mais difícil que o diamante, mas sua densidade é semelhante à da grafite.
No futuro, os cientistas pretendem traduzir a teoria em prática. Mas mesmo agora, o trabalho deles demonstra claramente que as possibilidades da ciência moderna são realmente infinitas, se, é claro, você prestar a devida atenção aos detalhes, lembrar de todas as nuances das leis da natureza e não ter medo de experimentar.
Sexta-feira off-top:
BBC , . ( , )
BBC , . ( , )
Fora da parte superior 2.0:
, , ? , , .. - …
, , ? , , .. - …
Obrigado pela atenção, fique curioso e tenha um ótimo final de semana, pessoal! :)
Um pouco de publicidade
Obrigado por ficar com a gente. Você gosta dos nossos artigos? Deseja ver materiais mais interessantes? Ajude-nos fazendo um pedido ou recomendando aos amigos o VPS na nuvem para desenvolvedores a partir de US $ 4,99 , um análogo exclusivo de servidores de nível básico que inventamos para você: Toda a verdade sobre o VPS (KVM) E5-2697 v3 (6 núcleos) 10 GB DDR4 480 GB SSD 1 Gbps de US $ 19 ou como dividir o servidor? (as opções estão disponíveis com RAID1 e RAID10, até 24 núcleos e até 40GB DDR4).
Dell R730xd 2 vezes mais barato no data center Equinix Tier IV em Amsterdã? Apenas temos 2 TVs Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV a partir de US $ 199 na Holanda!Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - a partir de US $ 99! Leia sobre Como construir a infraestrutura do bldg. classe usando servidores Dell R730xd E5-2650 v4 que custam 9.000 euros por centavo?